Quelle est la différence entre température et chaleur ?

Les exercices et leurs corrigés, c'est ici.
I - Notion de température
La température est une mesure de l'agitation (c'est à dire de l'energie totale) au niveau microscopique. Pour s'en convaincre, souvenons-nous de ce qui arrive à un grain de riz déposé dans le fond d'une casserolle remplie d'eau, et que l'on chauffe. Au début, le grain de riz reste au fond, puis commence à tressauter, faire de petit bond, et enfin monter et descendre.
Ce comportement est dû à la mise en mouvement des molécules d'eau sous l'effet d'un transfert de chaleur.
La chaleur est donc une énergie qui provoque une augmentation de l'énergie des constituants (atomes, molécules) d'un corps. L'apport de chaleur se traduit par une augmentation de l'agitation, et donc de l'énergie totale du système (ici, l'eau dans la casserole) : sa température augmente.
RETENONS :
- La température est une mesure de l'énergie de la matière à l'échelle microscopique.
- La chaleur est un transfert (désordonné) d'énergie. Elle se mesure donc en Joules (J).
Remarque :
Pour comprendre la structure de la matière, il est possible de consulter les cours sur la notion d'élements chimiques, la structure de l'atome, et la formation des molécules.
L'animation ci-dessous montre le lien entre l'agitation et la température.
Démarrer l'animation (flèche), puis cliquer sur + pour augmenter la température, et sur - pour la diminuer.
II - Echelles de température
Il existe deux échelles de températures connues : celle dont l'unité est le degré celsius (°C), et celle en degré Farenheit (°F) utilisée par les anglo saxons.
L'echelle des thermomètres, en degré celsius est graduée de 0°C à 100 °C. Cela correspond respectivement à la température de fusion de la glace et à la température d'ébullition de l'eau. Entre ces deux valeurs, les graduations sont égales.
Quand à la seconde unité, c'est le physicien allemand Daniel Gabriel Fahrenheit qui la proposa en 1724. Le zéro de son échelle correspond à la température la plus froide qu'il ait mesuré en hiver 1708-1709 dans sa ville natale de Dantzig, et 96°F est celle du sang (un recalibrage après sa mort porta la température du sang à 98,96°F).
Dans cette échelle, 0°C = 32°F, et 100°C = 212°F.
Il existe ainsi une relation entre les deux échelles :
°C = (°F - 32) x 5/9
ou
°F = °C x 9/5 + 32
Remarque : L'échelle celsius, après redéfinition, n'est plus tout à fait égale à l'échelle centigrade des thermomètres, mais la différence est si faible que, dans la pratique (hors météo), on confond les deux.
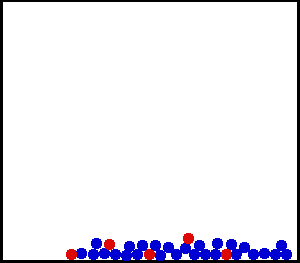
Nous avons vu dans le 1 que plus un corps est chaud, plus les particules qui le constituent sont agitées :
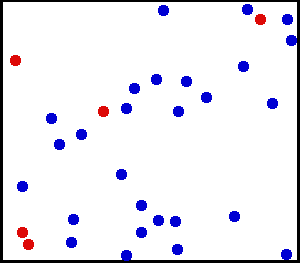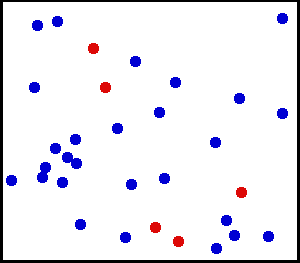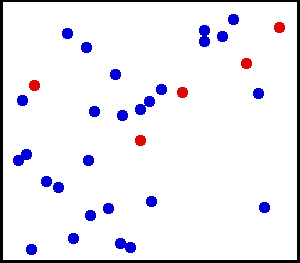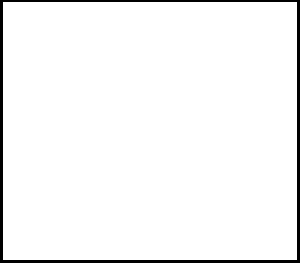
La température est une mesure de l'agitation des particules
Partons maintenant dans l'autre sens : refroidissons progressivement un corps. Les vibrations des molécules qui le constitue diminuent progressivement. Poursuivons ce refroidissement, petit à petit, jusqu'à ce que, lentement, tous les mouvements, et toute forme d'énergie, disparaissent dans les molécules, puis dans les atomes et leurs noyaux. Lorsque l'état "d'immobilité" totale de la matière est atteint (c'est à dire lorsque son énergie totale est nulle), il n'est pas possible d'aller plus loin. Nous avons atteint les limites du refroidissement.
Lorsqu'on supprime toute l'énergie des particules, nous avons atteint la température la plus basse qui puisse exister.
Cette température ultime est égale à -273,15°C. On peut alors définir une troisième unité de température : le kelvin (symbole K). La température limite prend alors pour valeur 0 K, ce qui fait que toutes les températures sont positives.
Dans cette échelle, la température de fusion de la glace est de 0°C = + 273,15 K. La température d'ébullition de l'eau est 100 °C = +373,15 K.

On peut constater sur l'image précédente que les échelles en kelvin et en celsius sont identiques, seule l'origine est décalée.
III - Les transferts de chaleur
Lorsque deux corps en contact sont à des températures différentes, l'agitation des contituants du corps le plus chaud heurtant ceux du corps froid, se propage de proche en proche. Ainsi, le corps chaud cède une partie de son énergie pour augmenter celle du corps froid. A la fin, les températures des deux systèmes sont égales, à une valeur comprise entre les températures initiales.

Considérons un gaz chaud (rouge), T
1 = 150 °C et un gaz froid (bleu), T
2 = 110 °C,
séparés par une cloison adiabatique (imperméable à la chaleur).

On ouvre la cloison, les molécules du gaz chaud, plus énergétiques, se déplacent vers le gaz froid.
Lors des chocs qui se produisent, le corps chaud cède une partie de son énergie au corps froid.
Le corps chaud se refroidit, et le corps froid s'échauffe.
T'
1<T
1, T'
2>T
2

Au bout de quelques temps, les énergies de toutes les molécules s'égalisent,
les deux corps possèdent alors la même température : T''
1 = T''
2 = 130°C.
Remarque : La température d'équilibre (température finale) n'est égale à la moyenne que si les gaz sont identiques et en même quantité.
Ce qui vient d'être dit est important : un corps se refroidit car
il perd de la chaleur, et il se réchauffe quand
il en gagne. C'est également vrai pour nous lorsque nous avons froid. Contrairement à une idée reçue, c'est la chaleur qui passe de notre corps vers l'extérieur, et non le "froid qui nous pénètre". Ainsi, les habits ont pour rôle
d'empêcher ce transfert de chaleur.
Il existe trois modes de transfert de la chaleur :
- La convection
Concerne les fluides (liquides, gaz). Les corps sont en contact, les échanges d'énergie se propage de proche en proche (exemple ci-dessus).
- La conduction
C'est le même principe, mais pour les solides. L'augmentation des vibrations des molécules se propagent de proche en proche.
- La radiation
La propagation se fait à distance, par rayonnement, comme c'est le cas avec le soleil. Sa chaleur ne peut pas se propager dans le vide par conduction ou convection puisque, par définition, il n'y a pas de matière. Par contre, son rayonnement (lumière, par exemple), transporte de l'énergie qui est récupéré par la matière pour augmenter sa température.
Ainsi, il ne faut pas confondre un convecteur et un radiateur. Le convecteur chauffe l'air proche de lui, et cette énergie est propagée de proche en proche par chaque molécule. C'est un phénomène assez long, mais adapté aux pièces fermées.
Le radiateur (généralement, on voit sa résistance très rouge) procure très rapidement la sensation de chaleur (le rayonnement se propage très vite). Il est donc surtout utilisé dans des pièces ouvertes sur l'extérieur, dans des ateliers, par exemple.
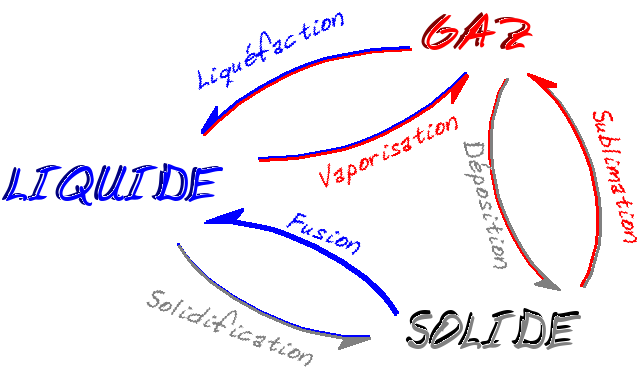
IV - Les changements d'état
Nous l'avons vu, la température est liée à l'agitation des atomes et des molécules d'un corps. A l'état gazeux, les molécules sont détachées les unes des autres, et occupent tout l'espace dans lequel elles se trouvent. Lorsque la température diminue, les molécules perdent leur énergie, prennent moins de place, jusqu'à se coller les unes aux autres : c'est l'état liquide.
Toutefois, elles ne sont pas figées. Elles vibrent sur elles-même, et peuvent également rouler les unes sur les autres (écoulement d'un liquide).
En diminuant encore la température, les positions se figent : c'est l'état solide. Mais leur énergie n'est pas nulle. Elles vibrent encore. Cette vibration diminue au fur et à mesure que l'on abaisse la température, jusqu'à s'annuler au zéro absolu (pratiquement impossible à atteindre).
Cette progression est par exemple celle de l'eau, à pression "normale", lorsqu'on diminue la température. Mais il existe des corps qui passent directement de l'état gazeux à l'état solide (ou l'inverse), l'iode par exemple. On peut ainsi observer les changements d'état suivants :
La déposition est parfois appelée sublimation inverse, ou condensation solide.
La liquéfaction peut également se trouver sous l'appellation condensation liquide.
V - Etude des changements d'état de l'eau
On réalise la manipulation suivante, dans laquelle on part de glace, à une température inférieure à 0°C, qu'on fait chauffer. On relève régulièrement la température en indiquant l'état physique dans lequel l'eau se trouve.
On trace ensuite la courbe de la température en fonction du temps.
L'animation ci-dessous (durée 4 min 10 s) simule (en accéléré) le résultat d'une telle expérience pour de l'eau pure :
On constate que durant tous les changements d'états, la température reste stable. Cela s'explique par le fait que toute la chaleur apportée sert à rompre les liaisons entre les molécules afin de les "désolidariser". Le passage de l'état solide à l'état liquide se traduit par la possibilité des molécules de glisser les unes par dessus les autres. De l'état liquide à l'état gazeux, elles doivent quitter le liquide pour évoluer dans tout l'espace qui leur est offert.
La quantité de chaleur nécessaire pour réaliser le changement d'état est appelée
chaleur latente. Pour l'eau, par exemple, elle est de 333 kJ/kg pour la fusion, et 2 260 kJ/kg pour la vaporisation. Cela signifie qu'il faut apporter 333 kJ de chaleur pour faire fondre 1 kg de glace.
Donc, si m est la masse d'eau, la quantité de chaleur nécessaire est 333 x m.
Retenons :
- La quantité de chaleur pour réaliser un changement d'état est Q = m.L
Q est la chaleur, en joules, m est la masse en kg et L est la chaleur latente en J/kg (ou kJ/kg).
On montre également que, lors de l'échauffement d'un corps, il existe une relation entre la quantité de chaleur échangée et la variation de température :
Q = m.c.(T2 - T1)
Q est la quantité de chaleur en joules, m la masse en kilogramme, c la capacité calorifique massique en J/kg/K, T
2 est la température finale et T
1 la température initiale. Les températures sont en kelvins.
Ainsi, si T
2>T
1, T
2-T
1>0 : Q est positive, ce qui signifie que le corps
reçoit de la chaleur.
si T
2<T
1, T
2-T
1<0 : Q est négative, le corps
fourni (perd) de la chaleur.
Il faut donc toujours bien identifier le système sur lequel s'effectuent les échanges de chaleur afin de comprendre :
- le signe de la quantité de chaleur
- la variation de la température